Відмінності між версіями «Джерело лінійчастих спектрів»
3517415 (обговорення • внесок) |
3517415 (обговорення • внесок) |
||
| Рядок 35: | Рядок 35: | ||
==Технічні характеристики== | ==Технічні характеристики== | ||
| + | |||
| + | Будова спектрів атомів також суперечить законам класичної фізики. Виходячи з класичної електродинаміки, електрон, рухаючись по орбіті, повинен рівномірно випромінювати енергію, а тому атомний спектр має бути суцільним. Насправді спектр пари і газів, тобто практично ізольованих атомів, лінійчастий. Частоти ліній у спектрі пов’язані з будовою хімічних елементів. Спектри поглинання і випромінювання речовини взаємооборотні. Спектр кожного елемента в газоподібному стані складається з комплексів ліній, що закономірно пов’язані між собою. Комплекс ліній, що підлягають певному закону, називають спектральною серією. Відстань між лініями зменшується при збільшенні частоти | ||
| + | |||
| + | [[Файл:Image956.jpg|Image956.jpg]] | ||
==Сфера застосування == | ==Сфера застосування == | ||
Версія за 21:13, 10 червня 2017
Демчик В`ячеслав, 31 група
Зміст
[сховати]Загальний опис (принцип дії)
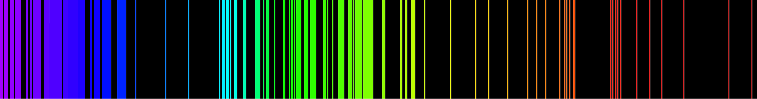
Лінійчатий спектр — оптичний спектр, що складається з окремих ліній.

Лінійчасті спектри характерні для газів, що складаються з окремих атомів або йонів, наприклад, атомів інертних газів або атомарного водню. Атомний спектр є також лінійчастим. Спектри багатоатомних молекул зазвичай смугасті, оскільки світлом збуджуються крім електронних ще й коливальні й обертові моди.
Лінійчасті спектри пояснюються переходами між дискретними енергетичними електронними рівнями.
Дві близько розташовані лінії в спектрі називаються дублетом, три — триплетом,чотири - чотириплетом. тощо.
А́томні спе́ктри — оптичні спектри, що утворюються при випромінюванні атомарної пари або газу. На відміну від суцільних спектрів твердих та рідких тіл і смугастих молекулярних спектрів атомні спектри складаються з окремих ліній, тобто є лінійчатими.
Випромінювання атомів зумовлене переходами атомів із стану з більшою енергією E2 у стан з меншою енергією E1.
Частота випромінювання ν визначається з формули
hν = E2 — E1, де h — стала Планка.
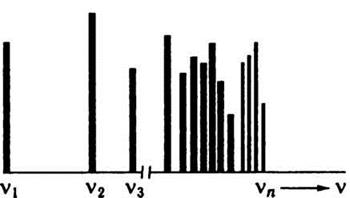
Спектральні лінії об'єднуються в спектральні серії. Найпростіший за будовою атом водню має кілька серій, в яких положення ліній добре визначається формулою Бальмера. В атомні спектри багатоелектронних атомів теж вдається згрупувати лінії в серії, але з складнішою закономірністю, ніж формула Бальмера.
Атомні спектри виникають при нагріванні газу або при електричному розряді всіх видів (дуга, іскра та ін.) через гази. В першому випадку причиною збудження атомів є зіткнення їх з іншими атомами, в другому — з електронами. Теорія атомних спектрів є основою спектрального аналізу.
Історична довідка
Технічні характеристики
Будова спектрів атомів також суперечить законам класичної фізики. Виходячи з класичної електродинаміки, електрон, рухаючись по орбіті, повинен рівномірно випромінювати енергію, а тому атомний спектр має бути суцільним. Насправді спектр пари і газів, тобто практично ізольованих атомів, лінійчастий. Частоти ліній у спектрі пов’язані з будовою хімічних елементів. Спектри поглинання і випромінювання речовини взаємооборотні. Спектр кожного елемента в газоподібному стані складається з комплексів ліній, що закономірно пов’язані між собою. Комплекс ліній, що підлягають певному закону, називають спектральною серією. Відстань між лініями зменшується при збільшенні частоти