Джерело лінійчастих спектрів
Демчик В`ячеслав, 31 група
Зміст
Загальний опис (принцип дії)
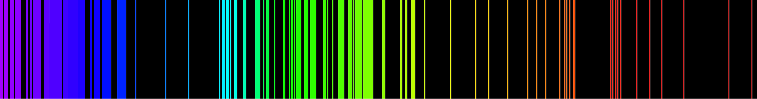
Лінійчатий спектр — оптичний спектр, що складається з окремих ліній.

Лінійчасті спектри характерні для газів, що складаються з окремих атомів або йонів, наприклад, атомів інертних газів або атомарного водню. Атомний спектр є також лінійчастим. Спектри багатоатомних молекул зазвичай смугасті, оскільки світлом збуджуються крім електронних ще й коливальні й обертові моди.
Лінійчасті спектри пояснюються переходами між дискретними енергетичними електронними рівнями.
Дві близько розташовані лінії в спектрі називаються дублетом, три — триплетом,чотири - чотириплетом. тощо.
А́томні спе́ктри — оптичні спектри, що утворюються при випромінюванні атомарної пари або газу. На відміну від суцільних спектрів твердих та рідких тіл і смугастих молекулярних спектрів атомні спектри складаються з окремих ліній, тобто є лінійчатими.
Випромінювання атомів зумовлене переходами атомів із стану з більшою енергією E2 у стан з меншою енергією E1.
Частота випромінювання ν визначається з формули
hν = E2 — E1, де h — стала Планка.
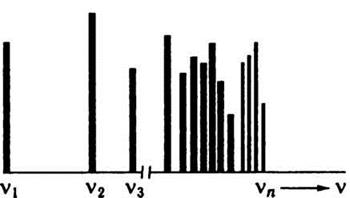
Спектральні лінії об'єднуються в спектральні серії. Найпростіший за будовою атом водню має кілька серій, в яких положення ліній добре визначається формулою Бальмера. В атомні спектри багатоелектронних атомів теж вдається згрупувати лінії в серії, але з складнішою закономірністю, ніж формула Бальмера.
Атомні спектри виникають при нагріванні газу або при електричному розряді всіх видів (дуга, іскра та ін.) через гази. В першому випадку причиною збудження атомів є зіткнення їх з іншими атомами, в другому — з електронами. Теорія атомних спектрів є основою спектрального аналізу.
Спектра́льний ана́ліз — сукупність методів визначення складу (наприклад, хімічного) об'єкта, заснований на вивченні спектрів взаємодії речовини з випромінюванням: спектри електромагнітного випромінювання, радіації, акустичних хвиль, розподілу за масою та енергією елементарних частинок та інше. Спектральний аналіз ґрунтується на явищі дисперсії світла. Традиційно розмежовують:
- атомарний та молекулярний спектральний аналіз, - «емісійний» — за спектром випромінення та «абсорбційний» — за спектром поглинання, - «мас-спектрометричний» — за спектром мас атомарних чи молекулярних іонів.
Існують такі види спектрів земних джерел і небесних тіл:
Суцільний, або неперервний спектр у вигляді райдужної смужки дають непрозорі розжарені тіла (вугілля, нитка електролампи) і досить протяжні густі маси газів. Лінійчастий спектр випромінювання дають розріджені гази й пара при сильному нагріванні. Кожний газ випромінює світло строго визначених довжин хвиль і дає характерний для даного хімічного елемента лінійчастий спектр. Значні зміни стану газу або умов його світіння, наприклад нагрівання чи іонізація, спричиняють певні зміни в спектрі цього газу. Складено таблиці, в яких перелічуються лінії кожного газу й зазначається яскравість кожної лінії. Наприклад, у спектрі пари натрію (Na) особливо яскравими є дві жовті лінії. Лінійчастий спектр поглинання дають гази й пара, якщо за ними міститься яскраве джерело, що дає неперервний спектр — це неперервний спектр, перерізаний темними лініями саме в тих місцях, де мають бути яскраві лінії, властиві даному газові. Наприклад, дві темні лінії поглинання пари натрію (Na) містяться в жовтій частині спектра.
Історична довідка
Ідентифікація хімічних елементів за оптичними спектрами атомів була запропонована у 1859 році Г. Кірхгофом та Бунзеном[1]. За допомогою спектрального аналізу гелій (He) був відкритий на Сонці раніше ніж на Землі. Але ще у 1854 році доктор Девід Альтер (англ. David Alter), науковець з міста Фріпорт, штату Пенсильванія (США) надрукував наукову працю[2], що описувала спектральні властивості 12 металів.
Технічні характеристики
Будова спектрів атомів також суперечить законам класичної фізики. Виходячи з класичної електродинаміки, електрон, рухаючись по орбіті, повинен рівномірно випромінювати енергію, а тому атомний спектр має бути суцільним. Насправді спектр пари і газів, тобто практично ізольованих атомів, лінійчастий. Частоти ліній у спектрі пов’язані з будовою хімічних елементів. Спектри поглинання і випромінювання речовини взаємооборотні. Спектр кожного елемента в газоподібному стані складається з комплексів ліній, що закономірно пов’язані між собою. Комплекс ліній, що підлягають певному закону, називають спектральною серією. Відстань між лініями зменшується при збільшенні частоти