Проект з ОІ та ІКТ і Хімії:"Будова атома. Досліди Резерфорда. Дуалізм електрона. Рівняння Бройля" - № 13 групи ПГФ, 2019
Зміст
"Будова атома. Досліди Резерфорда. Дуалізм електрона. Рівняння Бройля"
Ідея проекту
- Задум:
ознайомитися з будовою атома,дослідами Резерфорда,дуалізмом електрона,рівнянням Бройля
- Мета проекта:
вивчити і зрозуміти будову атома,досліди Резерфорда,дуалізм електрона,рівняння Бройля
- Передбачуваний результат:
грунтовне ознайомлення з цією темою
Автор проекту
Матеріали проекту
- Будова атома
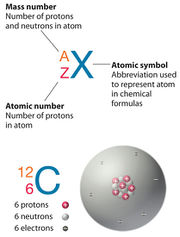
А́том (від дав.-гр. ἄτομος — «неподільний»,[1] або буквально «тіло, яке не можна розсікти навпіл»[2]) — з хімічної точки зору найменша, електронейтральна, хімічно неподільна частинка речовини. Фізична модель атома, у свою чергу, докладніше розкриває подробиці його будови. Відповідно до неї, атом складається з щільного ядра з позитивно заряджених протонів та електрично нейтральних нейтронів. Ядро оточене набагато більшою за розміром оболонкою з негативно заряджених електронів. Кількість протонів дорівнює кількості електронів, і тому атом є електрично нейтральним. В іншому випадку (при втраті чи набутті одного або кількох електронів) атом перетворюється на іон, що має певний позитивний чи негативний електричний заряд (у разі нестачі електронів такий іон називається катіоном, а у разі надлишку — аніоном). У свою чергу, склад ядра атома визначає собою тип атома та його ізотопа: заряд ядра Z визначається кількістю протонів у ядрі, а його масове число А — сумарною кількістю нейтронів та протонів. Таким чином, атом — динамічна й складна система субатомних частинок, урівноважених електростатичною взаємодією, слабкою та сильною ядерними силами.Атоми складаються з елементарних частинок (протонів, електронів, та нейтронів). Маса атома в основному зосереджена в ядрі, тому більша частина об'єму відносно порожня. Ядро оточене електронами. Кількість електронів дорівнює кількості протонів у ядрі, кількість протонів визначає порядковий номер елемента в періодичній системі. У нейтральному атомі сумарний негативний заряд електронів дорівнює позитивному зарядові протонів. Атоми одного елемента з різною кількістю нейтронів називаються ізотопами.
Оскільки найбільший внесок в масу атома вносять протони і нейтрони, повне число цих частинок у нукліді називають масовим числом. Значення масового числа близьке до атомної маси нукліда. Масу спокою нукліда часто наводять в атомних одиницях маси (а.о.м.) або Дальтонах (Да). Ця одиниця визначається як 1/12 частина маси спокою нейтрального атома Карбону-12, яка приблизно дорівнює 1,66 ×10-24 г[8]. Водень-1 або протій — найлегший ізотоп Гідрогену, і атом з найменшою масою, має масу близько 1,007825 а.о.м.[9]. Маса атома приблизно дорівнює добутку масового числа на атомну одиницю маси[10]. Найважчий стабільний ізотоп — Плюмбум-208[5] з масою 207,9766521 а.о.м.[11]. Через те, що маси навіть найважчих атомів у звичайних одиницях (наприклад, в грамах) дуже малі, в хімії для вимірювання кількості речовини використовують молі. В одному молі будь-якої речовини міститься одне й те саме число атомів (приблизно 6,022×1023). Це число (число Авогадро) вибране таким чином, що якщо маса елемента дорівнює 1 а.о.м., то моль атомів цього елемента буде мати масу 1 г. Наприклад, атом Карбону-12 має масу 12 а.о.м., тому 1 моль вуглецю має масу 12 г[8].
Розмір атома є величиною, що важко піддається вимірюванню, адже центральне ядро оточує розмита електронна хмара. Для атомів, що утворюють тверді кристали, відстань між суміжними вузлами кристалічної ґратки може слугувати наближеним значенням їхнього розміру. Для атомів, що кристалів не формують, використовують інші техніки оцінки, включаючи теоретичні розрахунки. Наприклад, розмір атома Гідрогену оцінюють як 1,2×10−10 м. Це значення можна порівняти з розміром протона (що є ядром атома водню): 0,87×10−15 м і переконатися в тому, що ядро атома водню в 100 000 разів менше, ніж сам атом. Атоми інших елементів зберігають приблизно те саме співвідношення. Причиною цього є те, що елементи із більшим позитивно-зарядженим ядром притягують електрони сильніше.
Ще одною характеристикою розмірів атома є радіус ван дер Ваальса — віддаль, на яку до даного атома може наблизитися інший атом. Міжатомні віддалі в молекулах характеризуються довжиною хімічних зв'язків або ковалентним радіусом.
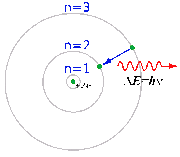
Між різними станами атомів можливі переходи, викликані зовнішнім збуренням, найчастіше електромагнітним полем. Внаслідок квантування станів атома оптичні спектри атомів складаються з окремих ліній, якщо енергія кванта світла не перевищує енергію іонізації. При вищих частотах оптичні спектри атомів стають неперервними. Ймовірність збудження атома світлом падає із подальшим ростом частоти, але різко зростає при певних характерних для кожного хімічного елемента частотах в рентгенівському діапазоні.
Збуджені атоми випромінюють кванти світла з тими ж частотами, на яких відбувається поглинання.
Переходи між різними станами атомів можуть викликатися також взаємодією зі швидкими зарядженими частинками.
Інтернет ресурси проекту
Додаткові матеріали проекту
Результати проекту
Звіт у вигляді презентації.