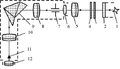Відмінності між версіями «Монохроматор УМ-2»
3469338 (обговорення • внесок) (→Історична довідка) |
3469338 (обговорення • внесок) (→Загальний опис) |
||
| Рядок 8: | Рядок 8: | ||
==Загальний опис== | ==Загальний опис== | ||
| − | + | Розрізняють два типи лінійчастого спектру - це спектр випромінення (Емісійний спектр) і спектр поглинання. На відміну від суцільних спектрів твердих та рідких тіл і смугастих молекулярних спектрів атомні спектри складаються з окремих ліній, тобто є лінійчатими. | |
| + | |||
| + | Випромінювання атомів зумовлене переходами атомів із стану з більшою енергією E<sub>2</sub> у стан з меншою енергією E<sub>1</sub>. | ||
| + | |||
| + | Частота випромінювання ν визначається з формули | ||
| + | |||
| + | hν = E<sub>2</sub> — E<sub>1</sub>, | ||
| + | |||
| + | де h — стала Планка. | ||
| + | |||
| + | Спектральні лінії об'єднуються в спектральні серії. Найпростіший за будовою атом водню має кілька серій, в яких положення ліній добре визначається формулою Бальмера. В атомні спектри багатоелектронних атомів теж вдається згрупувати лінії в серії, але з складнішою закономірністю, ніж формула Бальмера. | ||
| + | |||
| + | Атомні спектри виникають при нагріванні газу або при електричному розряді всіх видів (дуга, іскра та ін.) через гази. В першому випадку причиною збудження атомів є зіткнення їх з іншими атомами, в другому — з електронами. Теорія атомних спектрів є основою спектрального аналізу. | ||
===Спектральний аналіз та його застосування=== | ===Спектральний аналіз та його застосування=== | ||
Версія за 19:35, 24 травня 2017
Роботу виконує Баланюк Олександр 32гр.
Зміст
Спостереження лінійчатого спектру
Монохроматор УМ-2
Монохроматор УМ-2 призначений для проведення спектральних досліджень джерел світлового випромінювання, проведення якісного спектрального аналізу і вивчення спектральних залежностей коефіцієнтів відображення, прозорості і поглинання різних середовищ. Спектральний діапазон монохроматора УМ-2 становить від 400 до 1000 нм. Оптична схема УМ-2пріведена на рис.1. Світло від джерела проходить через вхідну щілину 7, встановлену в фокусі ахроматичні об'єктива коліматора 8 і далі паралельним пучком падає на диспергирующий елемент - призму Аббе. Монохроматор складається з двох труб і призменного блоку, розміщених на двох оптичних рейках. Труби монохроматора УМ-2 розташовані під кутом 90 °, а оптичні осі вхідний і вихідний труб монохроматора йдуть паралельно рейках.
Загальний опис
Розрізняють два типи лінійчастого спектру - це спектр випромінення (Емісійний спектр) і спектр поглинання. На відміну від суцільних спектрів твердих та рідких тіл і смугастих молекулярних спектрів атомні спектри складаються з окремих ліній, тобто є лінійчатими.
Випромінювання атомів зумовлене переходами атомів із стану з більшою енергією E2 у стан з меншою енергією E1.
Частота випромінювання ν визначається з формули
hν = E2 — E1,
де h — стала Планка.
Спектральні лінії об'єднуються в спектральні серії. Найпростіший за будовою атом водню має кілька серій, в яких положення ліній добре визначається формулою Бальмера. В атомні спектри багатоелектронних атомів теж вдається згрупувати лінії в серії, але з складнішою закономірністю, ніж формула Бальмера.
Атомні спектри виникають при нагріванні газу або при електричному розряді всіх видів (дуга, іскра та ін.) через гази. В першому випадку причиною збудження атомів є зіткнення їх з іншими атомами, в другому — з електронами. Теорія атомних спектрів є основою спектрального аналізу.
Спектральний аналіз та його застосування
Вивчення атомних і молекулярних спектрів випромінювання і поглинання покладено в основу спеціального методу дослідження складу і будови речовини — спектрального аналізу. Він грунтується на кількісних і якісних методах дослідження спектрів електромагнітного випромінювання речовин, які спостерігають за допомогою спеціальних приладів — спектрографів і спектрометрів. Принцип дії цих приладів грунтується на їх здатності виокремлювати в просторі і часі з усього світлового потоку певні ділянки випромінювання. їх можна фіксувати фотографічним способом або вимірювати різні їхні характеристики — зміну світлового потоку, довжину хвилі спектральної лінії тощо
Історична довідка
1802 року Вільям Волластон помітив у спектрі Сонця сім темних смуг. 1814 року їх незалежно відкрив і описав німецький фізиком Йозеф фон Фраунгофер. Пізніше він склав каталог, у якому описав 574 лінії. Сильні лінії отримали літерні позначення від A до K, а слабші були позначені рештою літер. Сучасні каталоги містять десятки тисяч фраунгоферових ліній.
Фраунгоферові лінії є важливим джерелом про хімічний склад зоряних атмосфер. У 1859 у Кірхгоф і Бунзен довели, що ідентифіковані лінії спектру емісії однозначно характеризують хімічні елементи, які їх випромінюють. Так було доведено, що в атмосфері Сонця наявні такі елементи, як водень, залізо, хром, кальцій, натрій та ін. в різних ступенях іонізації. Загалом у спектрі Сонця ототожнено лінії 72 елементів. Саме на Сонці вперше спектроскопічними методами було відкрито гелій. На основі цього було встановлено також зв'язок ліній поглинання — Фраунгоферових ліній, на спектрі адсорбції з певним хімічним елементом чи його іоном.
Технічні характеристики
Технічні характеристики
Власне джерела лінійчастих спектрів
Припустимо, що газ складається з атомів деякого хімічного елемента (В нашому випадку нітрогену) і розріджений настільки, що атоми майже не взаємодіють один з одним. Розкладаючи в спектр випромінювання такий газ (нагрітий до досить високої температури), ми побачимо приблизно таку картину (рис. 3). Цей лінійчатий спектр, утворений тонкими ізольованими різнокольоровими лініями, називається спектром випромінювання.
Будь-який атомарний розріджений газ випромінює світло з лінійчатим спектром. Більше того, для кожного хімічного елемента спектр випромінювання виявляється унікальним, граючи роль «паспортом» цього елементу. По набору ліній спектра випромінювання можна однозначно сказати, з яким хімічним елементом ми маємо справу.
Оскільки газ розріджений і атоми мало взаємодіють один з одним, ми можемо зробити висновок, що світло випромінюють атоми самі по собі. Таким чином, атом характеризується дискретним, строго певним набором довжин хвиль випромінюваного світла. У кожного хімічного елемента, як ми вже сказали, цей набір свій.