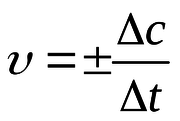Відмінності між версіями «Проект з ОІ та ІКТ і Хімії: "Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт." - № 13 ПГФ, 2019»
8464551 (обговорення • внесок) |
8464551 (обговорення • внесок) |
||
| Рядок 14: | Рядок 14: | ||
нтенсивність проходження хімічних реакцій визначається швидкістю, тобто зміною концентрації реагента або продукту реакції за одиницю часу: | нтенсивність проходження хімічних реакцій визначається швидкістю, тобто зміною концентрації реагента або продукту реакції за одиницю часу: | ||
| + | [[Файл:Img-ErsSfk.png|міні]] | ||
де С – молярна концентрація реагента, а t – час. Мінус перед правим членом обумовлений зниженням концентрації реагента в ході реакції. У виразі швидкості реакції за зміною концентрації продукту реакції мінус не ставиться. Отже, швидкість реакції завжди додатня. | де С – молярна концентрація реагента, а t – час. Мінус перед правим членом обумовлений зниженням концентрації реагента в ході реакції. У виразі швидкості реакції за зміною концентрації продукту реакції мінус не ставиться. Отже, швидкість реакції завжди додатня. | ||
| Рядок 20: | Рядок 21: | ||
Швидкість хімічної реакції залежить від: | Швидкість хімічної реакції залежить від: | ||
| − | + | ||
температури: у разі підвищення температури на кожні 10 °С швидкість реакції зростає у два-чотири рази (правило Вант-Гоффа), Для початку хімічної реакції реагенти повинні мати певний запас енергії. Ця енергія Еа називається енергією активації, тобто це енергія, яку повинні мати молекули, що зіштовхуються, щоб зіткнення привело до хімічного перетворення. | температури: у разі підвищення температури на кожні 10 °С швидкість реакції зростає у два-чотири рази (правило Вант-Гоффа), Для початку хімічної реакції реагенти повинні мати певний запас енергії. Ця енергія Еа називається енергією активації, тобто це енергія, яку повинні мати молекули, що зіштовхуються, щоб зіткнення привело до хімічного перетворення. | ||
природи реагентів, | природи реагентів, | ||
Версія за 09:31, 22 жовтня 2019
Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт.
Зміст
Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт.
Ідея проекту
Вивчити вплив різних чинників на швидкість і рівновагу фізико-хімічних процесів.
Автор проекту
Сідельник Олександра Михайлівна
Матеріали проекту
нтенсивність проходження хімічних реакцій визначається швидкістю, тобто зміною концентрації реагента або продукту реакції за одиницю часу:
де С – молярна концентрація реагента, а t – час. Мінус перед правим членом обумовлений зниженням концентрації реагента в ході реакції. У виразі швидкості реакції за зміною концентрації продукту реакції мінус не ставиться. Отже, швидкість реакції завжди додатня.
Швидкість хімічної реакції залежить від:
температури: у разі підвищення температури на кожні 10 °С швидкість реакції зростає у два-чотири рази (правило Вант-Гоффа), Для початку хімічної реакції реагенти повинні мати певний запас енергії. Ця енергія Еа називається енергією активації, тобто це енергія, яку повинні мати молекули, що зіштовхуються, щоб зіткнення привело до хімічного перетворення.
природи реагентів,
концентрації реагентів (Закон діючих мас),
опромінення,
присутності каталізатора
Інтернет ресурси проекту
Додаткові матеріали проекту
Результати проекту
Звіт у вигляді презентації.