Відмінності між версіями «Проект з ОІ та ІКТ і Хімії:"Будова атома. Досліди Резерфорда. Дуалізм електрона. Рівняння Бройля" - № 13 групи ПГФ, 2019»
8464402 (обговорення • внесок) |
8464402 (обговорення • внесок) |
||
| (не показано одну проміжну версію цього учасника) | |||
| Рядок 103: | Рядок 103: | ||
[https://pin.it/cx5bu6qt45tf2d Колекція посилань по темі "Будова атома. Досліди Резерфорда. Дуалізм електрона. Рівняння Бройля"] | [https://pin.it/cx5bu6qt45tf2d Колекція посилань по темі "Будова атома. Досліди Резерфорда. Дуалізм електрона. Рівняння Бройля"] | ||
| − | |||
| − | |||
[[Файл:Презентація_ікт_-_копия0968.pdf|міні]] | [[Файл:Презентація_ікт_-_копия0968.pdf|міні]] | ||
==Результати проекту== | ==Результати проекту== | ||
| − | |||
[https://drive.google.com/file/d/1uvmMAFUiT5PqejdSjKR0YWqKDhL0Bxyi/view Презентація] | [https://drive.google.com/file/d/1uvmMAFUiT5PqejdSjKR0YWqKDhL0Bxyi/view Презентація] | ||
Поточна версія на 10:32, 24 грудня 2019
Зміст
"Будова атома. Досліди Резерфорда. Дуалізм електрона. Рівняння Бройля"
Ідея проекту
- Задум:
ознайомитися з будовою атома,дослідами Резерфорда,дуалізмом електрона,рівнянням Бройля
- Мета проекта:
вивчити і зрозуміти будову атома,досліди Резерфорда,дуалізм електрона,рівняння Бройля
- Передбачуваний результат:
грунтовне ознайомлення з цією темою
Автор проекту
Матеріали проекту
- Будова атома
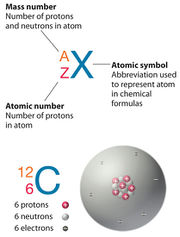
А́том (від дав.-гр. ἄτομος — «неподільний»,[1] або буквально «тіло, яке не можна розсікти навпіл»[2]) — з хімічної точки зору найменша, електронейтральна, хімічно неподільна частинка речовини. Фізична модель атома, у свою чергу, докладніше розкриває подробиці його будови. Відповідно до неї, атом складається з щільного ядра з позитивно заряджених протонів та електрично нейтральних нейтронів. Ядро оточене набагато більшою за розміром оболонкою з негативно заряджених електронів. Кількість протонів дорівнює кількості електронів, і тому атом є електрично нейтральним. В іншому випадку (при втраті чи набутті одного або кількох електронів) атом перетворюється на іон, що має певний позитивний чи негативний електричний заряд (у разі нестачі електронів такий іон називається катіоном, а у разі надлишку — аніоном). У свою чергу, склад ядра атома визначає собою тип атома та його ізотопа: заряд ядра Z визначається кількістю протонів у ядрі, а його масове число А — сумарною кількістю нейтронів та протонів. Таким чином, атом — динамічна й складна система субатомних частинок, урівноважених електростатичною взаємодією, слабкою та сильною ядерними силами.Атоми складаються з елементарних частинок (протонів, електронів, та нейтронів). Маса атома в основному зосереджена в ядрі, тому більша частина об'єму відносно порожня. Ядро оточене електронами. Кількість електронів дорівнює кількості протонів у ядрі, кількість протонів визначає порядковий номер елемента в періодичній системі. У нейтральному атомі сумарний негативний заряд електронів дорівнює позитивному зарядові протонів. Атоми одного елемента з різною кількістю нейтронів називаються ізотопами.
Оскільки найбільший внесок в масу атома вносять протони і нейтрони, повне число цих частинок у нукліді називають масовим числом. Значення масового числа близьке до атомної маси нукліда. Масу спокою нукліда часто наводять в атомних одиницях маси (а.о.м.) або Дальтонах (Да). Ця одиниця визначається як 1/12 частина маси спокою нейтрального атома Карбону-12, яка приблизно дорівнює 1,66 ×10-24 г[8]. Водень-1 або протій — найлегший ізотоп Гідрогену, і атом з найменшою масою, має масу близько 1,007825 а.о.м.[9]. Маса атома приблизно дорівнює добутку масового числа на атомну одиницю маси[10]. Найважчий стабільний ізотоп — Плюмбум-208[5] з масою 207,9766521 а.о.м.[11]. Через те, що маси навіть найважчих атомів у звичайних одиницях (наприклад, в грамах) дуже малі, в хімії для вимірювання кількості речовини використовують молі. В одному молі будь-якої речовини міститься одне й те саме число атомів (приблизно 6,022×1023). Це число (число Авогадро) вибране таким чином, що якщо маса елемента дорівнює 1 а.о.м., то моль атомів цього елемента буде мати масу 1 г. Наприклад, атом Карбону-12 має масу 12 а.о.м., тому 1 моль вуглецю має масу 12 г[8].
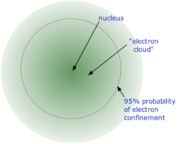
Розмір атома є величиною, що важко піддається вимірюванню, адже центральне ядро оточує розмита електронна хмара. Для атомів, що утворюють тверді кристали, відстань між суміжними вузлами кристалічної ґратки може слугувати наближеним значенням їхнього розміру. Для атомів, що кристалів не формують, використовують інші техніки оцінки, включаючи теоретичні розрахунки. Наприклад, розмір атома Гідрогену оцінюють як 1,2×10−10 м. Це значення можна порівняти з розміром протона (що є ядром атома водню): 0,87×10−15 м і переконатися в тому, що ядро атома водню в 100 000 разів менше, ніж сам атом. Атоми інших елементів зберігають приблизно те саме співвідношення. Причиною цього є те, що елементи із більшим позитивно-зарядженим ядром притягують електрони сильніше.
Ще одною характеристикою розмірів атома є радіус ван дер Ваальса — віддаль, на яку до даного атома може наблизитися інший атом. Міжатомні віддалі в молекулах характеризуються довжиною хімічних зв'язків або ковалентним радіусом.
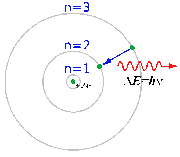
Між різними станами атомів можливі переходи, викликані зовнішнім збуренням, найчастіше електромагнітним полем. Внаслідок квантування станів атома оптичні спектри атомів складаються з окремих ліній, якщо енергія кванта світла не перевищує енергію іонізації. При вищих частотах оптичні спектри атомів стають неперервними. Ймовірність збудження атома світлом падає із подальшим ростом частоти, але різко зростає при певних характерних для кожного хімічного елемента частотах в рентгенівському діапазоні.
Збуджені атоми випромінюють кванти світла з тими ж частотами, на яких відбувається поглинання.
Переходи між різними станами атомів можуть викликатися також взаємодією зі швидкими зарядженими частинками.
- Досліди Резерфорда.
Перша спроба створення моделі атома на основі нагромаджених експериментальних даних належить Дж. Томсону (1903р.). Згідно з цією моделлю атом є рівномірно зарядженою кулею радіусом ~ , всередині якої біля своїх положень рівноваги коливаються електрони; сумарний від’ємний заряд електронів дорівнює додатному заряду кулі. Модель Томсона виявилась неправильною.
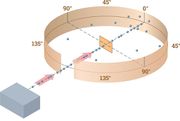
Спрощена схема досліду Резерфорда зображена на рисДжерело a- частинок поміщене всередині свинцевої порожнини з вузьким каналом. Усі a-частинки, крім тих, що рухаються всередині вузького каналу, поглинаються свинцем. Потік a-частинок, пройшовши через вузьку діафрагму Д, потрапляє на тонку золоту фольгу Ф завтовшки , що складається з декількох атомних шарів. При проходженні через фольгу a-частинки відхиляються на різні кути і потрапляють на екран Е, який можна поміщати в різних положеннях відносно фольги. Екран покритий флюоресцентною речовиною. За допомогою мікроскопа М можна спостерігати місця потрапляння a-частинок за свіченням екрану. Поведінку a-частинок після проходження через фольгу вивчали в камері Вільсона.
Резерфорд з’ясував, що потік a-частинок, пройшовши крізь фольгу, майже не відхиляється від прямолінійного напрямку і лише деякі частинки змінють напрямок руху, відхиляючись на дуже великі кути, близько 135 – 150° На підставі досліду Резерфорд зробив такі висновки.
1. Оскільки переважна більшість a-частинок проходить через атоми, не змінюючи свого напрямку, то атом прозорий і частинки, на яких відбувається розсіювання, займають об’єм значно менший за об’єм атома.
2. Тому що при розсіюванні спостерігаються кути відхилення a-частинок близько 150°, то взаємодіють одноіменно заряджені частинки, тобто розсіювання відбувається на позитивно заряджених частинках.
3. Після проходження a-частинкою фольги в камері Вільсона спостерігалися треки однакової довжини, які належать лише a-частинці. Отже, маса частинки, на якій відбувається розсіювання, значно більша від маси a-частинки і через це вона не отримує прискорення.
4. Резерфорд приблизно розрахував розмір частинки, на якій відбувається розсіювання.
На підставі результатів дослідів з розсіянням a-частинок тонкими фольгами Резерфорд запропонував ядерну модель атома.
Згідно з цією моделлю в центрі атома знаходиться ядро, в якому зосереджено позитивний заряд Ze і практично вся маса атома. Лінійні розміри ядра ~ .
Навколо ядра в області з лінійними розмірами ~ по замкнених орбітах рухаються Z електронів, утворюючи електронну оболонку атома.
- Дуалізм електрона.
Електро́н (грец. Ηλεκτρόνιο, англ. electron, нім. Elektron) — стабільна, негативно заряджена елементарна частинка, що входить до складу всіх атомів. Має електричний заряд (-е= −1,6021892(46)×10−19 Кл) і масу (9,109554(906)×10−31 кг). Електрон — стабільна частинка, його час життя принаймні перевищує 1026 років. Електрон — частинка, для якої найяскравіше проявляються хвильові властивості. Дебройлівська довжина хвилі електрона має порядок розміру атома. Саме це дозволяє електрона зв'язуватися з ядром атома, а також брати участь в утворенні хімічних зв'язків між атомами у молекулі чи твердому тілі. Електрон належить до родини лептонів, має електричний заряд −e, спін {\displaystyle \hbar /2}{\displaystyle \hbar /2}. Електрон є лептоном першого покоління, бере участь в електромагнітній, слабкій та гравітаційній взаємодіях. Фактор Ланде для електрона дорівнює 2, значення g-фактора −2,0023193043622(15).
- Рівняння Бройля
Хвилі де Бройля — основний компонент корпускулярно-хвильового дуалізму Луї де Бройля, який у середині 20-х років 20-го століття запропонував аксіоматичну квантову теорію, яка лягла в основу хвильової механіки, зокрема рівняння Шредінгера. Основна думка де Бройля полягає у розповсюдженні основних законів квантової теорії світла (вірніше випромінювання Планка - Ейнштейна) на рух матеріальних частинок певної маси. З рухом будь-якої вільної частинки, яка має енергію Основна думка де Бройля полягає у розповсюдженні основних законів квантової теорії світла (вірніше випромінювання Планка - Ейнштейна) на рух матеріальних частинок певної маси. З рухом будь-якої вільної частинки, яка має енергію Неможливо розібрати вираз (невідома помилка): E
та імпульс Неможливо розібрати вираз (невідома помилка): \mathbf{p}
, де Бройль зв'язує плоску хвилю
- Неможливо розібрати вираз (невідома помилка): \psi(\mathbf{r},t) =C\cdot e^{i(\omega t - \mathbf{k}\mathbf{r})}
де Неможливо розібрати вираз (невідома помилка): \mathbf{r}
- радіус- вектор частинки, що вільно рухається, Неможливо розібрати вираз (невідома помилка): t
- час. Частота цієї хвилі Неможливо розібрати вираз (невідома помилка): \omega
та її хвильовий вектор Неможливо розібрати вираз (невідома помилка): \mathbf{k}
зв'язані з енергією та імпульсом частинки такими ж рівняннями, що справедливі і для квантів світла, тобто:
- Неможливо розібрати вираз (невідома помилка): E = \hbar\omega, \mathbf{p} = \hbar\mathbf{k} \
.
Це і є основні рівняння де Бройля.
Інтернет ресурси проекту
Стаття на Вікіпедії про атомну теорію
ТЕОРІЯ БУДОВИ АТОМІВ ТА ПЕРІОДИЧНИЙ ЗАКОН
Досліди Резерфорда.Ядерна модель атома
Стаття на Вікіпедії про Електрон
Додаткові матеріали проекту
Колекція посилань по темі "Будова атома. Досліди Резерфорда. Дуалізм електрона. Рівняння Бройля"