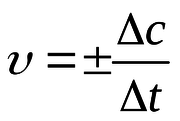Відмінності між версіями «Проект з ОІ та ІКТ і Хімії: "Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт." - № 13 ПГФ, 2019»
8464551 (обговорення • внесок) |
8464551 (обговорення • внесок) |
||
| (не показані 33 проміжні версії цього учасника) | |||
| Рядок 1: | Рядок 1: | ||
Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт. | Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт. | ||
| − | =='''''<font color='blue' size=6> | + | =='''''<font color='blue' size=6>Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт.</font>'''''== |
| − | |||
==Ідея проекту== | ==Ідея проекту== | ||
| − | + | Вивчити вплив різних чинників на швидкість і рівновагу фізико-хімічних процесів. | |
==Автор проекту== | ==Автор проекту== | ||
| − | + | Сідельник Олександра Михайлівна | |
== Матеріали проекту == | == Матеріали проекту == | ||
| + | [https://drive.google.com/file/d/10dOu_B39o1maSw98x0ccHl6WJxAXZu21/view?usp=sharing Звіт у вигляді презентації] | ||
| − | |||
| − | + | Інтенсивність проходження хімічних реакцій визначається швидкістю, тобто зміною концентрації реагента або продукту реакції за одиницю часу: | |
| − | + | [[Файл:Img-ErsSfk.png|міні]] | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | де С – молярна концентрація реагента, а t – час. Мінус перед правим членом обумовлений зниженням концентрації реагента в ході реакції. У виразі швидкості реакції за зміною концентрації продукту реакції мінус не ставиться. Отже, швидкість реакції завжди додатня. | ||
| + | |||
| + | |||
| + | Швидкість хімічної реакції залежить від: | ||
| + | |||
| + | |||
| + | температури: у разі підвищення температури на кожні 10 °С швидкість реакції зростає у два-чотири рази (правило Вант-Гоффа), Для початку хімічної реакції реагенти повинні мати певний запас енергії. Ця енергія Еа називається енергією активації, тобто це енергія, яку повинні мати молекули, що зіштовхуються, щоб зіткнення привело до хімічного перетворення. | ||
| + | природи реагентів, | ||
| + | концентрації реагентів (Закон діючих мас), | ||
| + | опромінення, | ||
| + | присутності каталізатора | ||
[[Категорія:Проект з ІКТ і Хімії (Природничо-географічний факультет)]] | [[Категорія:Проект з ІКТ і Хімії (Природничо-географічний факультет)]] | ||
| Рядок 31: | Рядок 45: | ||
===Інтернет ресурси проекту=== | ===Інтернет ресурси проекту=== | ||
| + | [https://uk.wikipedia.org/wiki/%D0%A8%D0%B2%D0%B8%D0%B4%D0%BA%D1%96%D1%81%D1%82%D1%8C_%D1%85%D1%96%D0%BC%D1%96%D1%87%D0%BD%D0%BE%D1%97_%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D1%96%D1%97 Швидкість хімічної реакції] | ||
| + | |||
| + | [https://disted.edu.vn.ua/courses/learn/1589 Швидкість хімічной реакції, залежність швидкості реакції від різних чинників ] | ||
===Додаткові матеріали проекту=== | ===Додаткові матеріали проекту=== | ||
| + | [https://www.pinterest.com/pin/450148925253284058/?nic=1a «Хімічне шоу»: на що здатна цікава наука хімія] | ||
| + | [[таблиця до проекту "Залежнысть швидкосты хымычного реакції від температури. Температурний коефіцієнт."]] | ||
==Результати проекту== | ==Результати проекту== | ||
Звіт у вигляді презентації. | Звіт у вигляді презентації. | ||
Поточна версія на 10:39, 24 грудня 2019
Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт.
Зміст
Залежність швидкості хімічної реакції від температури. Температурний коефіцієнт.
Ідея проекту
Вивчити вплив різних чинників на швидкість і рівновагу фізико-хімічних процесів.
Автор проекту
Сідельник Олександра Михайлівна
Матеріали проекту
Інтенсивність проходження хімічних реакцій визначається швидкістю, тобто зміною концентрації реагента або продукту реакції за одиницю часу:
де С – молярна концентрація реагента, а t – час. Мінус перед правим членом обумовлений зниженням концентрації реагента в ході реакції. У виразі швидкості реакції за зміною концентрації продукту реакції мінус не ставиться. Отже, швидкість реакції завжди додатня.
Швидкість хімічної реакції залежить від:
температури: у разі підвищення температури на кожні 10 °С швидкість реакції зростає у два-чотири рази (правило Вант-Гоффа), Для початку хімічної реакції реагенти повинні мати певний запас енергії. Ця енергія Еа називається енергією активації, тобто це енергія, яку повинні мати молекули, що зіштовхуються, щоб зіткнення привело до хімічного перетворення.
природи реагентів,
концентрації реагентів (Закон діючих мас),
опромінення,
присутності каталізатора
Інтернет ресурси проекту
Швидкість хімічной реакції, залежність швидкості реакції від різних чинників
Додаткові матеріали проекту
«Хімічне шоу»: на що здатна цікава наука хімія
Результати проекту
Звіт у вигляді презентації.