Відмінності між версіями «Проект з ОІ та ІКТ і Хімії: " Кислоти, основи, амфотерні гідроксиди, солі у світлі теорії електролітичної дисоціації. " - № групи ХБ19Б ПГФ, 2019.»
8464944 (обговорення • внесок) |
8464944 (обговорення • внесок) |
||
| (не показано 8 проміжних версій цього учасника) | |||
| Рядок 1: | Рядок 1: | ||
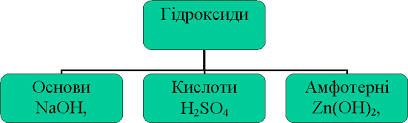
=='''''<font color='red' size=6> Кислоти, основи, амфотерні гідроксиди, солі у світлі теорії електролітичної дисоціації.</font>'''''== | =='''''<font color='red' size=6> Кислоти, основи, амфотерні гідроксиди, солі у світлі теорії електролітичної дисоціації.</font>'''''== | ||
| − | + | [[Файл:Кислоттттт.png|Кислоттттт.png]] | |
==Ідея проекту== | ==Ідея проекту== | ||
Розширити знання студентів про класифікацію, номенклатуру, хімічні властивості і способи добування кислот. | Розширити знання студентів про класифікацію, номенклатуру, хімічні властивості і способи добування кислот. | ||
| + | |||
| + | |||
| + | |||
| + | [[Категорія:Проект з ІКТ і Хімії (Природничо-географічний факультет)]]. | ||
==Автор проекту== | ==Автор проекту== | ||
| Рядок 16: | Рядок 20: | ||
Кислоты как класс химических соединений, обладающих рядом близких свойств, известны с древнейших времён. | Кислоты как класс химических соединений, обладающих рядом близких свойств, известны с древнейших времён. | ||
| − | В 1778 году французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в их составе кислорода. Эта гипотеза оказалась несостоятельной, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу | + | В 1778 году французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в их составе кислорода. Эта гипотеза оказалась несостоятельной, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу. В 1833 году немецкий химик Юстус Либих определил кислоту как водородсодержащее соединение, в котором водород может быть замещён на металл. |
| − | Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. В его теории, сформулированной в 1887 году, кислота определялась как соединение, диссоциирующее в водном растворе с образованием ионов водорода H+ | + | Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. В его теории, сформулированной в 1887 году, кислота определялась как соединение, диссоциирующее в водном растворе с образованием ионов водорода H+. Теория Аррениуса быстро показала свою ограниченность. Во-первых, было выяснено, что невозможно представить существование несольватированного катиона Н+ в растворе; во-вторых, теория Аррениуса не учитывала влияние растворителя на кислотно-основные равновесия; наконец, теория оказалась неприменима к неводным системам. |
| − | Согласно сольвентной теории Франклина, созданной в 1924 году, кислотой называлось вещество, при растворении увеличивавшее число тех же катионов, которые образуются при диссоциации растворителя. Данная теория сыграла важную роль в исследовании неводных растворов кислот. Химическая теория кислот и оснований формировалась в работах А. Ганча (1917—1927). По Ганчу, кислотами называются соединения водорода, в которых последний может быть замещён на металл или неметаллический радикал с образованием соли | + | Согласно сольвентной теории Франклина, созданной в 1924 году, кислотой называлось вещество, при растворении увеличивавшее число тех же катионов, которые образуются при диссоциации растворителя. Данная теория сыграла важную роль в исследовании неводных растворов кислот. Химическая теория кислот и оснований формировалась в работах А. Ганча (1917—1927). По Ганчу, кислотами называются соединения водорода, в которых последний может быть замещён на металл или неметаллический радикал с образованием соли. |
| − | В 1923 году появились теории кислот и оснований Брёнстеда — Лоури и Льюиса, широко применяемые в настоящее время | + | В 1923 году появились теории кислот и оснований Брёнстеда — Лоури и Льюиса, широко применяемые в настоящее время. |
| − | Кислота в теории Брёнстеда — Лоури[ | + | '''Кислота в теории Брёнстеда — Лоури''' |
| + | |||
| + | [[Файл:Теорія.pdf-2.jpg|міні]] | ||
Согласно теории Брёнстеда — Лоури, уксусная кислота, передавая протон в реакции с водой, выступает как кислота Брёнстеда. При этом образуются ацетат-ион и катион гидроксония, являющиеся парой сопряжённое основание — сопряжённая кислота. | Согласно теории Брёнстеда — Лоури, уксусная кислота, передавая протон в реакции с водой, выступает как кислота Брёнстеда. При этом образуются ацетат-ион и катион гидроксония, являющиеся парой сопряжённое основание — сопряжённая кислота. | ||
В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо и почти одновременно датским учёным Й. Брёнстедом и английским учёным Т.-М. Лоури (Лаури), кислотой называется соединение или молекулярный ион, способные отдавать протон другому химическому соединению — основанию[5]. Согласно теории Брёнстеда — Лоури, в химическом взаимодействии кислот и оснований всегда принимают участие кислота — донор протона (кислота Брёнстеда) и сопряженное с ней основание — любое соединение, способное присоединять протон (основание Брёнстеда). Поскольку основание может быть рассмотрено как продукт отщепления протона от кислоты, электрический заряд сопряженной кислоты всегда на единицу меньше, чем заряд сопряженного с ней основания. Так, например, кислоте HCl соответствует сопряженное с ней основание — хлорид-ион Cl−[6][2]. | В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо и почти одновременно датским учёным Й. Брёнстедом и английским учёным Т.-М. Лоури (Лаури), кислотой называется соединение или молекулярный ион, способные отдавать протон другому химическому соединению — основанию[5]. Согласно теории Брёнстеда — Лоури, в химическом взаимодействии кислот и оснований всегда принимают участие кислота — донор протона (кислота Брёнстеда) и сопряженное с ней основание — любое соединение, способное присоединять протон (основание Брёнстеда). Поскольку основание может быть рассмотрено как продукт отщепления протона от кислоты, электрический заряд сопряженной кислоты всегда на единицу меньше, чем заряд сопряженного с ней основания. Так, например, кислоте HCl соответствует сопряженное с ней основание — хлорид-ион Cl−[6][2]. | ||
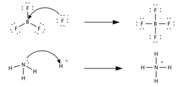
| − | Кислота в теории Льюиса | + | '''Кислота в теории Льюиса''' |
Кислота Льюиса (А) является акцептором электронной пары основания Льюиса (В) и образует с ним ковалентную связь | Кислота Льюиса (А) является акцептором электронной пары основания Льюиса (В) и образует с ним ковалентную связь | ||
| − | Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Н. Льюисом, кислота — это вещество, принимающее электронную пару и образующее связь с основанием Льюиса за счёт этой пары электронов | + | Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Н. Льюисом, кислота — это вещество, принимающее электронную пару и образующее связь с основанием Льюиса за счёт этой пары электронов. Кислотами в теории Льюиса могут быть молекулы с незаполненной восьмиэлектронной оболочкой (BF3, SO3), катионы металлов-комплексообразователей (Fe2+, Zn2+), галогениды переходных металлов (TiCl4), молекулы с полярными двойными связями (SO2), карбокатионы. По сравнению с теорией Брёнстеда — Лоури, теория Льюиса является более общей и охватывает более широкий круг кислот. |
| − | + | [[Файл:Lewis.png|міні]] | |
| − | + | ||
| + | Ключевым свойством, определяющим способность взаимодействия кислоты Льюиса с основанием Льюиса, является энергетическое соответствие между низшей свободной молекулярной орбиталью, принимающей электронную пару, и высшей занятой молекулярной орбиталью, с которой эта электронная пара уходит. Эта способность была учтена в рамках принципа жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО). Данный принцип устанавливает, что наиболее склонны взаимодействовать мягкие кислоты с мягкими основаниями и жёсткие кислоты с жёсткими основаниями. При этом под жёсткими кислотами понимаются кислоты Льюиса, обладающие большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Напротив, мягкие кислоты обладают малым положительным зарядом, низкой электроотрицательностью и высокой поляризуемостью. Поскольку данные свойства изменяются плавно, ряд кислот Льюиса занимает промежуточное положение между жёсткими и мягкими. Принцип ЖМКО не имеет количественного критерия оценки силы кислот, поэтому он не может быть применён для аналитических расчётов. | ||
| + | |||
| + | ===Інтернет ресурси проекту=== | ||
| + | [http://zno.academia.in.ua/mod/book/view.php?id=3743&chapterid=1460 ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ] | ||
[https://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B кислоти] | [https://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B кислоти] | ||
| + | |||
| + | [https://uk.wikipedia.org/wiki/%D0%9E%D1%81%D0%BD%D0%BE%D0%B2%D0%B8_(%D1%85%D1%96%D0%BC%D1%96%D1%8F) основи] | ||
===Додаткові матеріали проекту=== | ===Додаткові матеріали проекту=== | ||
| − | + | ||
| + | [[Таблиця до проекту "Кислоти, основи, амфотерні гідроксиди, солі у світлі теорії електролітичної дисоціації.",№ 13 групи ПГФ, 2019]] | ||
==Результати проекту== | ==Результати проекту== | ||
| − | Звіт у вигляді презентації | + | .. |
| + | |||
| + | [https://drive.google.com/file/d/1QeOQ664aXlJF3Co7kZXONslsJI8cW9ws/view?usp=sharing Звіт у вигляді презентації] | ||
Поточна версія на 10:57, 24 грудня 2019
Зміст
Кислоти, основи, амфотерні гідроксиди, солі у світлі теорії електролітичної дисоціації.
Ідея проекту
Розширити знання студентів про класифікацію, номенклатуру, хімічні властивості і способи добування кислот..
Автор проекту
Ворона Аліна
Матеріали проекту
История развития представлений о кислотах[править | править код]
Создатель первой теории кислот и оснований С. Аррениус Кислоты как класс химических соединений, обладающих рядом близких свойств, известны с древнейших времён.
В 1778 году французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в их составе кислорода. Эта гипотеза оказалась несостоятельной, так как многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Тем не менее, именно эта гипотеза дала название кислороду как химическому элементу. В 1833 году немецкий химик Юстус Либих определил кислоту как водородсодержащее соединение, в котором водород может быть замещён на металл.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. В его теории, сформулированной в 1887 году, кислота определялась как соединение, диссоциирующее в водном растворе с образованием ионов водорода H+. Теория Аррениуса быстро показала свою ограниченность. Во-первых, было выяснено, что невозможно представить существование несольватированного катиона Н+ в растворе; во-вторых, теория Аррениуса не учитывала влияние растворителя на кислотно-основные равновесия; наконец, теория оказалась неприменима к неводным системам.
Согласно сольвентной теории Франклина, созданной в 1924 году, кислотой называлось вещество, при растворении увеличивавшее число тех же катионов, которые образуются при диссоциации растворителя. Данная теория сыграла важную роль в исследовании неводных растворов кислот. Химическая теория кислот и оснований формировалась в работах А. Ганча (1917—1927). По Ганчу, кислотами называются соединения водорода, в которых последний может быть замещён на металл или неметаллический радикал с образованием соли.
В 1923 году появились теории кислот и оснований Брёнстеда — Лоури и Льюиса, широко применяемые в настоящее время.
Кислота в теории Брёнстеда — Лоури
Согласно теории Брёнстеда — Лоури, уксусная кислота, передавая протон в реакции с водой, выступает как кислота Брёнстеда. При этом образуются ацетат-ион и катион гидроксония, являющиеся парой сопряжённое основание — сопряжённая кислота. В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо и почти одновременно датским учёным Й. Брёнстедом и английским учёным Т.-М. Лоури (Лаури), кислотой называется соединение или молекулярный ион, способные отдавать протон другому химическому соединению — основанию[5]. Согласно теории Брёнстеда — Лоури, в химическом взаимодействии кислот и оснований всегда принимают участие кислота — донор протона (кислота Брёнстеда) и сопряженное с ней основание — любое соединение, способное присоединять протон (основание Брёнстеда). Поскольку основание может быть рассмотрено как продукт отщепления протона от кислоты, электрический заряд сопряженной кислоты всегда на единицу меньше, чем заряд сопряженного с ней основания. Так, например, кислоте HCl соответствует сопряженное с ней основание — хлорид-ион Cl−[6][2].
Кислота в теории Льюиса
Кислота Льюиса (А) является акцептором электронной пары основания Льюиса (В) и образует с ним ковалентную связь Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Н. Льюисом, кислота — это вещество, принимающее электронную пару и образующее связь с основанием Льюиса за счёт этой пары электронов. Кислотами в теории Льюиса могут быть молекулы с незаполненной восьмиэлектронной оболочкой (BF3, SO3), катионы металлов-комплексообразователей (Fe2+, Zn2+), галогениды переходных металлов (TiCl4), молекулы с полярными двойными связями (SO2), карбокатионы. По сравнению с теорией Брёнстеда — Лоури, теория Льюиса является более общей и охватывает более широкий круг кислот.
Ключевым свойством, определяющим способность взаимодействия кислоты Льюиса с основанием Льюиса, является энергетическое соответствие между низшей свободной молекулярной орбиталью, принимающей электронную пару, и высшей занятой молекулярной орбиталью, с которой эта электронная пара уходит. Эта способность была учтена в рамках принципа жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО). Данный принцип устанавливает, что наиболее склонны взаимодействовать мягкие кислоты с мягкими основаниями и жёсткие кислоты с жёсткими основаниями. При этом под жёсткими кислотами понимаются кислоты Льюиса, обладающие большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Напротив, мягкие кислоты обладают малым положительным зарядом, низкой электроотрицательностью и высокой поляризуемостью. Поскольку данные свойства изменяются плавно, ряд кислот Льюиса занимает промежуточное положение между жёсткими и мягкими. Принцип ЖМКО не имеет количественного критерия оценки силы кислот, поэтому он не может быть применён для аналитических расчётов.
Інтернет ресурси проекту
ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
Додаткові матеріали проекту
Результати проекту
..