Відмінності між версіями «Проект з ОІ та ІКТ і Хімії: " Вода, її склад і електронна будова. Фізичні і хімічні властивості, аномальні властивості. " - № групи ХБ19Б ПГФ, 2019.»
8464480 (обговорення • внесок) |
8464480 (обговорення • внесок) |
||
| (не показано 27 проміжних версій цього учасника) | |||
| Рядок 1: | Рядок 1: | ||
| − | =='''''<font color=' | + | =='''''<font color='blue' size=5>" Вода, її склад і електронна будова. Фізичні і хімічні властивості, аномальні властивості."</font >'''''== |
| − | + | [[Файл:Вода(H2O).jpg|міні]] | |
==Ідея проекту== | ==Ідея проекту== | ||
| − | Мета проекту | + | '''Мета проекту''' : вивчити та дослідити особливоті складу , будови воду. Розглянути фізичні та хімічні властивості води. |
| + | |||
| + | |||
| + | |||
| Рядок 13: | Рядок 16: | ||
== Матеріали проекту == | == Матеріали проекту == | ||
| + | |||
| + | <big>'''Вода, Н2O'''</big>— хімічна речовина у вигляді прозорої, безбарвної рідини без запаху і смаку, (в нормальних умовах). У природі існує у трьох агрегатних станах — твердому (лід), рідкому (вода) і газоподібному (водяна пара). Молекула води складається з одного атома оксигену і двох атомів гідрогену. Атоми гідрогену розташовані в молекулі так, що напрямки до них утворюють кут 104,45o із вершиною в центрі атома оксигену. Таке розташування зумовлює молекулі води дипольний момент у 1,844 Дебая. При заміні атомів гідрогену (протонів) на атоми дейтерію утворюється модифікація, яка називається важкою водою. | ||
| + | |||
| + | '''Вода''' — одна із найголовніших речовин, потрібних для органічного життя. Рослини та тварини містять понад 60 % води за масою. На Землі водою покрито 70,9 % поверхні. Вона здійснює у природі постійний кругообіг, випаровуючись з поверхні й повертаючись на неї у вигляді атмосферних опадів. Вода має велике значення для економіки: сільського господарства й промисловості. Прісні води, придатні для пиття, становлять лише 2,5 % від загальної кількості води на Землі. Нестача води може стати однією з найгостріших проблем людства в найближчі десятиліття. | ||
| + | |||
| + | ----'''Фізичні властивості.''' | ||
| + | |||
| + | [[Файл:Slide-777.jpg|міні]] | ||
| + | Чиста вода – це безбарвна прозора густина. Густина води при переході її з твердого стану в рідкий не зменшується, як майже в усіх інших речовин, а зростає. При 4 С має максимальну густину і лише при дальшому нагріванні її густина зменшується з підвищенням температу. | ||
| + | |||
| + | Коли б при зниженні температури і переході з рідкого стану в твердий густина води змінювалася б так само, як це буває у більшості речовин, то з наближенням зими поверхневі шари прісних вод охолоджувалися б до 0 С і опускалися б на дно, звільняючи місце теплішим шарам, і так тривало б доти, поки вся маса водойми не мала б температуру 0 С. Далі вода починала б замерзати, а крижини, що утворилися, опускалися б на дно і водойма промерзла б на всю глибину. При цьому багато форм життя у воді було б неможливим. Проте оскільки найбільшої густини вода досягає при 4 С, то процес переміщення її шарів доходить до цієї температури, після чого більше охолоджений шар лишається на поверхні, замерзає і тим самим захищає шари, що лежать нижче, від дальшого охолодження і замерзання. | ||
| + | |||
| + | Велике значення у житті природи має і те, що воді властива аномальна висока температура ( теплоємність ) І 4,18 Дж /(г : к ) І*. Тому в нічний час, а також у період переходу від літа до зими, вода охолоджується повільно, а вдень, або в період переходу від зими до літа, так само повільно нагрівається, будучи, таким чином, регулятором на земній кулі. | ||
| + | |||
| + | Атом кисню у молекулі перебуває в стані sр - гібридизації. Тому валентний кут Н О Н ( 104,3 ) близький до тетраедричного ( 109,5 ). Електрони, що утворюють зв’язки О – н, зміщені до більш електронегативного атома кисню, в результаті чого атоми водню набувають ефективних позитивних зарядів. | ||
| + | |||
| + | Неподілені електронні пари, що перебувають на гібридних sр - орбіталях, зміщені відносно ядра атома кисню і утворюють два негативні плюси. | ||
| + | |||
| + | Під час нагрівання води частина теплоти витрачається на розрив водневих зв’язків ( енергія розриву водневого зв’язку у воді становить приблизно 25 кДж/моль).Цим пояснюється теплоємність води. | ||
| + | |||
| + | Водневі зв’язки між молекулами води повністю розривається тільки тоді, коли вада переходить в пару. При 20 С у рідкій воді зберігається ще близько половини водневих зв’язків. | ||
| + | |||
| + | ----'''Хімічні властивості.''' | ||
| + | [[Файл:7516502977777ef.jpeg|міні]] | ||
| + | Молекули води дуже стійкі проти нагрівання. Однак при температурах, вищих за 1000 С, водяна пара починає розкладатися на водень і кисень: | ||
| + | |||
| + | '''2Н О 2Н + О''' | ||
| + | |||
| + | Процес розкладання речовин в результаті її нагрівання називається термічною дисоціацією. Термічна дисоціація води відбувається з поглинанням теплоти. При температурі 2000 С ступінь термічної дисоціації - воднем і киснем все ще залишається зміщеною в бік водяної пари. При охолодженні ж нижче за 1000 С рівновага практично повністю зміщується у цьому напрямі. | ||
| + | |||
| + | Вода – дуже реакційно здатна речовина. Оксиди багатьох металів і неметалів сполучаються з водою, утворюючи основи і кислоти; деякі солі з водою кристалогідрати; найактивніші метали взаємодіють з водою з виділенням водню. | ||
| + | |||
| + | Вода також має кристалічну здатність. Якщо немає слідів вологи, то практично не відбуваються деякі звичайні реакції: наприклад, хлор не взаємодіє з металами, фтороводень не роз’їдає скло, натрій не окислюється в атмосфері повітря. | ||
| + | |||
| + | Вода здатна утворювати сполуки з рядом речовин, що перебувають за звичайних умов у газоподібному стані і звичайно не мають великої хімічної активності. | ||
| + | |||
| + | Прикладом можуть бути гідрати Хе : '''6Н О, СН : 6Н О,С Н Сl :15Н О'''. Такі сполуки утворюються в результаті заповнення молекулами газу міжмолекулярних порожнин, які є в структурі води, і називаються сполуками включення. | ||
| + | |||
| + | ----''' Діаграма стану води.''' | ||
| + | [[Файл:Фаза.jpg|міні]] | ||
| + | ''Діаграма стану'' - це графічне зображення залежності між різними величинами, що характеризують стан системи. | ||
| + | |||
| + | Діаграму застосовують у хімії для однокомпонентних систем, що показують залежності між тиском і температурою. Вона складається з трьох кривих, що розмежовують усі можливі температури і тиски на при ділянки, які відповідають льоду, рідині і парі. | ||
| + | |||
| + | Перетворення, які відбуваються з водою при атмосферному тиску, відбито на діаграмі точками або відрізками, розміщеними на горизонталі, що відповідає '''101,3 кПа'''. Так, топлення льоду або кристалізація вади відповідає точці '''D''', а кипіння води – точці '''Е''', нагрівання або охолодження - відрізку '''DЕ'''. | ||
| + | |||
| + | Так відомі речовини, потрібна точка яких лежить при тиску, що перевищує атмосферний. У цьому випадку нагрівання кристалів при атмосферному тиску приводить не до плавлення цієї речовини, а до її сублілеації – перетворення твердої фази безпосередньо в газо подібну. Діаграми стану вивчають для ряду речовин, що мають наукове і практичне значення. | ||
| + | |||
| + | ----'''Аномальність води''' | ||
| + | <gallery> | ||
| + | Файл:Аномальність води.jpg| | ||
| + | |||
| + | </gallery> | ||
===Інтернет ресурси проекту=== | ===Інтернет ресурси проекту=== | ||
| Рядок 26: | Рядок 82: | ||
===Додаткові матеріали проекту=== | ===Додаткові матеріали проекту=== | ||
| − | [[Вода, її склад і електронна будова. Фізичні і хімічні властивості, аномальні властивості. ]] | + | |
| + | [https://www.pinterest.ru/karinahalilan0/вода-її-склад-і-електронна-будова-фізичні-і-хімічн/ Колекція посилань з теми Вода, її склад і електронна будова. Фізичні і хімічні властивості, аномальні властивості.] | ||
| + | |||
| + | [[Таблиця до проекту "Вода, її склад і електронна будова. Фізичні і хімічні властивості, аномальні властивості.",№ 13 групи ПГФ, 2019]] | ||
| + | |||
| + | [[Файл:Стінгазета77.JPG]] | ||
| + | |||
| + | |||
| + | |||
==Результати проекту== | ==Результати проекту== | ||
| − | Звіт у вигляді презентації.. | + | Звіт у вигляді презентації |
| + | [https://drive.google.com/file/d/1taWI53jqbdw-bGgus0HC8kOMhhIWy6mU/view?usp=sharing "Вода" ] | ||
| + | |||
| + | [[Проект з ІКТ та Хімії]] | ||
Поточна версія на 10:32, 24 грудня 2019
Зміст
" Вода, її склад і електронна будова. Фізичні і хімічні властивості, аномальні властивості."
Ідея проекту
Мета проекту : вивчити та дослідити особливоті складу , будови воду. Розглянути фізичні та хімічні властивості води..
Автор проекту
Матеріали проекту
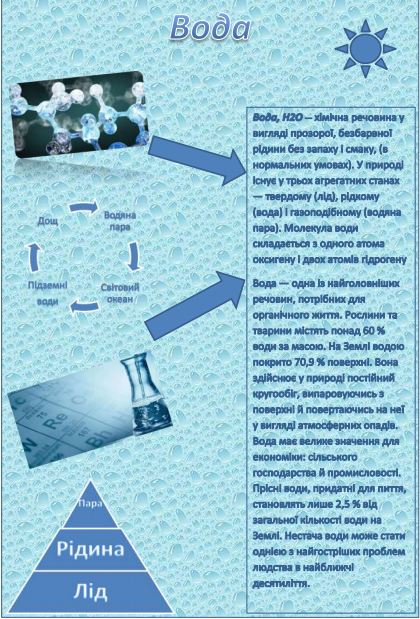
Вода, Н2O— хімічна речовина у вигляді прозорої, безбарвної рідини без запаху і смаку, (в нормальних умовах). У природі існує у трьох агрегатних станах — твердому (лід), рідкому (вода) і газоподібному (водяна пара). Молекула води складається з одного атома оксигену і двох атомів гідрогену. Атоми гідрогену розташовані в молекулі так, що напрямки до них утворюють кут 104,45o із вершиною в центрі атома оксигену. Таке розташування зумовлює молекулі води дипольний момент у 1,844 Дебая. При заміні атомів гідрогену (протонів) на атоми дейтерію утворюється модифікація, яка називається важкою водою.
Вода — одна із найголовніших речовин, потрібних для органічного життя. Рослини та тварини містять понад 60 % води за масою. На Землі водою покрито 70,9 % поверхні. Вона здійснює у природі постійний кругообіг, випаровуючись з поверхні й повертаючись на неї у вигляді атмосферних опадів. Вода має велике значення для економіки: сільського господарства й промисловості. Прісні води, придатні для пиття, становлять лише 2,5 % від загальної кількості води на Землі. Нестача води може стати однією з найгостріших проблем людства в найближчі десятиліття.
Фізичні властивості.
Чиста вода – це безбарвна прозора густина. Густина води при переході її з твердого стану в рідкий не зменшується, як майже в усіх інших речовин, а зростає. При 4 С має максимальну густину і лише при дальшому нагріванні її густина зменшується з підвищенням температу.
Коли б при зниженні температури і переході з рідкого стану в твердий густина води змінювалася б так само, як це буває у більшості речовин, то з наближенням зими поверхневі шари прісних вод охолоджувалися б до 0 С і опускалися б на дно, звільняючи місце теплішим шарам, і так тривало б доти, поки вся маса водойми не мала б температуру 0 С. Далі вода починала б замерзати, а крижини, що утворилися, опускалися б на дно і водойма промерзла б на всю глибину. При цьому багато форм життя у воді було б неможливим. Проте оскільки найбільшої густини вода досягає при 4 С, то процес переміщення її шарів доходить до цієї температури, після чого більше охолоджений шар лишається на поверхні, замерзає і тим самим захищає шари, що лежать нижче, від дальшого охолодження і замерзання.
Велике значення у житті природи має і те, що воді властива аномальна висока температура ( теплоємність ) І 4,18 Дж /(г : к ) І*. Тому в нічний час, а також у період переходу від літа до зими, вода охолоджується повільно, а вдень, або в період переходу від зими до літа, так само повільно нагрівається, будучи, таким чином, регулятором на земній кулі.
Атом кисню у молекулі перебуває в стані sр - гібридизації. Тому валентний кут Н О Н ( 104,3 ) близький до тетраедричного ( 109,5 ). Електрони, що утворюють зв’язки О – н, зміщені до більш електронегативного атома кисню, в результаті чого атоми водню набувають ефективних позитивних зарядів.
Неподілені електронні пари, що перебувають на гібридних sр - орбіталях, зміщені відносно ядра атома кисню і утворюють два негативні плюси.
Під час нагрівання води частина теплоти витрачається на розрив водневих зв’язків ( енергія розриву водневого зв’язку у воді становить приблизно 25 кДж/моль).Цим пояснюється теплоємність води.
Водневі зв’язки між молекулами води повністю розривається тільки тоді, коли вада переходить в пару. При 20 С у рідкій воді зберігається ще близько половини водневих зв’язків.
Хімічні властивості.
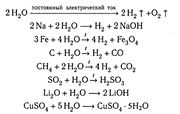
Молекули води дуже стійкі проти нагрівання. Однак при температурах, вищих за 1000 С, водяна пара починає розкладатися на водень і кисень:
2Н О 2Н + О
Процес розкладання речовин в результаті її нагрівання називається термічною дисоціацією. Термічна дисоціація води відбувається з поглинанням теплоти. При температурі 2000 С ступінь термічної дисоціації - воднем і киснем все ще залишається зміщеною в бік водяної пари. При охолодженні ж нижче за 1000 С рівновага практично повністю зміщується у цьому напрямі.
Вода – дуже реакційно здатна речовина. Оксиди багатьох металів і неметалів сполучаються з водою, утворюючи основи і кислоти; деякі солі з водою кристалогідрати; найактивніші метали взаємодіють з водою з виділенням водню.
Вода також має кристалічну здатність. Якщо немає слідів вологи, то практично не відбуваються деякі звичайні реакції: наприклад, хлор не взаємодіє з металами, фтороводень не роз’їдає скло, натрій не окислюється в атмосфері повітря.
Вода здатна утворювати сполуки з рядом речовин, що перебувають за звичайних умов у газоподібному стані і звичайно не мають великої хімічної активності.
Прикладом можуть бути гідрати Хе : 6Н О, СН : 6Н О,С Н Сl :15Н О. Такі сполуки утворюються в результаті заповнення молекулами газу міжмолекулярних порожнин, які є в структурі води, і називаються сполуками включення.
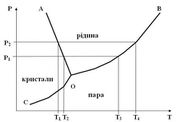
Діаграма стану води.
Діаграма стану - це графічне зображення залежності між різними величинами, що характеризують стан системи.
Діаграму застосовують у хімії для однокомпонентних систем, що показують залежності між тиском і температурою. Вона складається з трьох кривих, що розмежовують усі можливі температури і тиски на при ділянки, які відповідають льоду, рідині і парі.
Перетворення, які відбуваються з водою при атмосферному тиску, відбито на діаграмі точками або відрізками, розміщеними на горизонталі, що відповідає 101,3 кПа. Так, топлення льоду або кристалізація вади відповідає точці D, а кипіння води – точці Е, нагрівання або охолодження - відрізку DЕ.
Так відомі речовини, потрібна точка яких лежить при тиску, що перевищує атмосферний. У цьому випадку нагрівання кристалів при атмосферному тиску приводить не до плавлення цієї речовини, а до її сублілеації – перетворення твердої фази безпосередньо в газо подібну. Діаграми стану вивчають для ряду речовин, що мають наукове і практичне значення.
Аномальність води
Інтернет ресурси проекту
https://uk.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%B0
https://allref.com.ua/uk/skachaty/Voda_-_fizichni_i_himichni_vlastivosti
https://pidruchniki.com/77192/prirodoznavstvo/voda_znachennya_vlastivosti_osoblivosti_budovi_molekul
http://ru.osvita.ua/vnz/reports/biolog/26029/
Додаткові матеріали проекту
Результати проекту
Звіт у вигляді презентації "Вода"